25年專注國內外醫械谘詢服務
列表
口罩等防疫用品出口歐盟及美國市場認證信息指南
文章出處:政策解讀 網站編輯: 迅恩醫療 閱讀量: 發表時間:2020-06-05 17:55:11為做好新冠肺炎疫情防控和經濟社會發展工作,支持企業複工複產,針對企業不熟悉防疫物資出口政策等實際問題,現就口罩等防疫用品出口歐盟及美國的相關準入要求及梳理的國內具有相應資質能力的認證機構名錄提供如下信息指南,供企業參考。
一、歐盟對口罩等防疫用品準入要求
(一)口罩
歐盟根據用途將口罩分為兩類:醫用口罩和個人防護口罩。
1.醫用口罩
醫用口罩需按照歐盟醫療器械指令93/42/EEC(MDD)或歐盟醫療器械條例EU2017/745(MDR)加貼CE標誌,對應的標準是EN14683。根據口罩產品無菌或非無菌狀態,采取的合格評定模式也不同。
(1)無菌醫用口罩:必須由授權公告機構進行CE認證。
(2)非無菌醫用口罩:企業隻需進行CE自我符合性聲明,不需要通過公告機構認證。在準備好相應文件及測試報告等資料後,即可自行完成符合性聲明。
2. 個人防護口罩
個人防護口罩不屬於醫療器械,但需符合歐盟個人防護設備條例EU2016/425(PPE)要求,由授權公告機構進行CE認證並頒發證書,對應的標準是EN149。
(二)防護服
防護服也分為醫用防護服和個人防護服,管理要求與口罩基本類似。醫用防護服按照醫療器械管理,其中無菌醫用防護服需按照歐盟醫療器械指令93/42/EEC(MDD)或歐盟醫療器械條例EU2017/745(MDR)獲得CE認證,非無菌醫用防護服隻需進行CE自我聲明。個人防護服需按照歐盟個人防護設備條例EU2016/425(PPE)獲得CE認證。
(三) 歐盟公告機構查詢地址
1.歐盟醫療器械指令93/42/EEC(MDD)授權的公告機構查詢地址:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=13
2.歐盟醫療器械條例EU 2017/745(MDR)授權的公告機構查詢地址:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=34
3.歐盟個人防護裝備條例EU2016/425(PPE)授權的公告機構查詢地址:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=155501
二、美國對口罩等防疫用品準入要求
(一)口罩
美國對醫用口罩和防護口罩同樣區分管理,其中醫用口罩由美國食品藥品監督管理局(FDA)管理,而個人防護口罩則由美國國家職業安全衛生研究所(NiosesH)管理。
1. 醫用口罩
醫用口罩需通過FDA注冊,企業直接向FDA官網申請並提交相關材料。此外還有兩種可選途徑:
(1)已經獲得NiosesH注冊的N95口罩,在產品生物學測試、阻燃測試和血液穿透測試通過的情況下,可以豁免產品上市登記(510K),直接進行FDA工廠注冊和醫療器械列名。
(2)如果獲得持有510K的製造商的授權,可以作為其代工廠使用其510K批準號進行企業注冊和器械列名。
2. 個人防護口罩
防護口罩需通過NiosesH注冊,企業直接在NiosesH官網申請。
(二)防護服
對醫用防護服和個人防護服的管理也類似於口罩的管理方式,其中醫用防護服由美國食品藥品監督管理局(FDA)管理,而個人防護服由美國國家職業安全衛生研究所(NiosesH)管理。企業直接在FDA或NiosesH進行注冊申請。
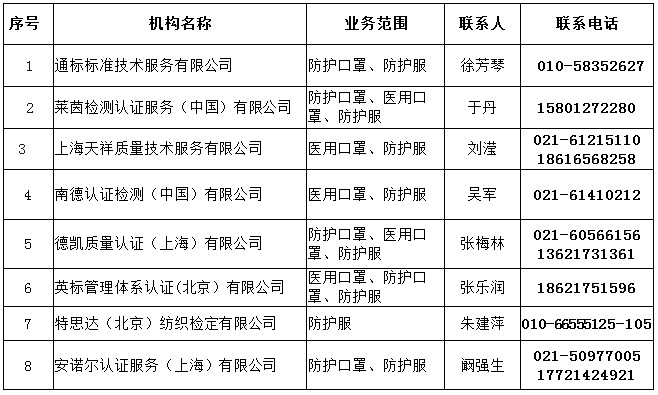
三、中國境內具有口罩等防疫用品CE認證能力的認證機構名錄
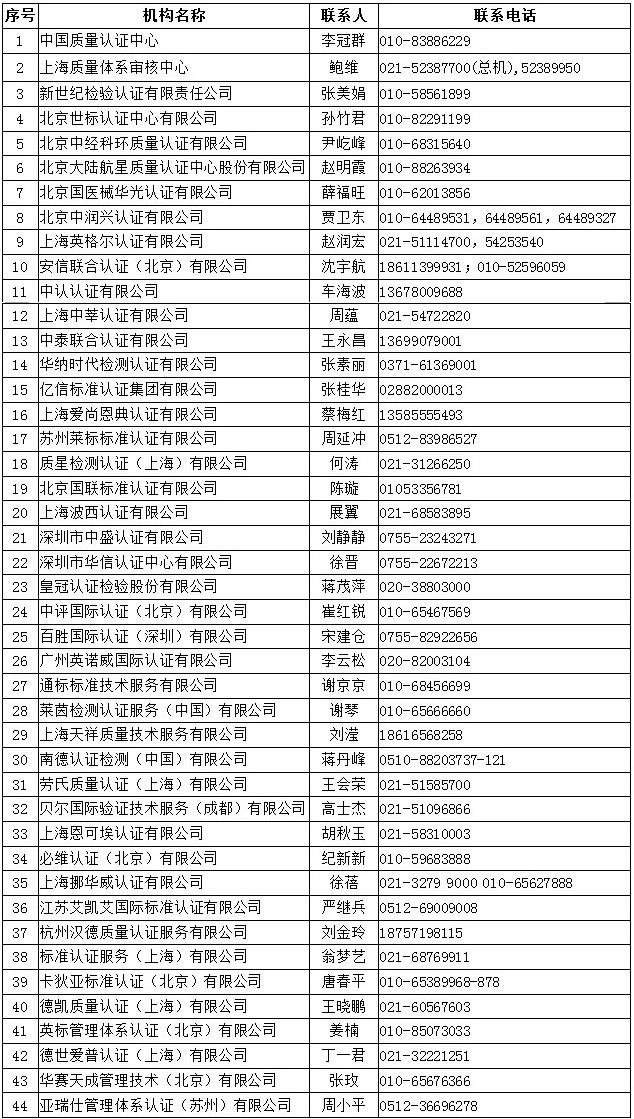
四、中國境內可以開展醫療器械管理體係(ISO13485)認證的機構名錄
熱門文章
最新資訊
- 二類醫療器械注冊證代辦為何備受關注?
- 二類醫療器械生產許可證辦理流程具體是什麽?
- 醫療器械生產許可證怎麽辦理才省心?這三點是你需知的
- 一類醫療器械經營許可證怎麽辦理才更快速?
- 三類醫療器械經營許可證代辦機構要怎麽選擇?一分鍾了解
- 醫療器械三類經營許可證辦理要了解哪些方麵
- 二類醫療器械經營許可證辦理條件有哪些?
- 二類醫療器械注冊需要多長時間?需要的資料多嗎
- 二類醫療器械注冊需要哪些資料?怎麽選擇代辦機構
- 二類醫療器械注冊代辦的優勢在哪裏?看這三點
- 三類醫療器械注冊申報流程複雜嗎?代辦可靠嗎
- 一類醫療器械備案流程會很多嗎?怎麽做才正確
- 三類醫療器械注冊要求會很高嗎?一分鍾了解
- 第二類醫療器械注冊證辦理難度高嗎?要注意什麽
- 第三類醫療器械注冊流程主要包含了什麽內容
- 二類醫療器械注冊證怎麽申請?代辦輕鬆嗎
- 三類醫療器械注冊證取得流程複雜嗎?要什麽材料
- 一類醫療器械備案代理優勢是什麽?真的安全嗎
- 二類醫療器械注冊證辦理的壓力會很大嗎
- 三類醫療器械注冊證怎麽辦理?代辦機構可信嗎
-

在線客服
在線谘詢
-

聯係電話
熱線電話
15813158929
-

關注我們
手機掃一掃打開

-

回到頂部